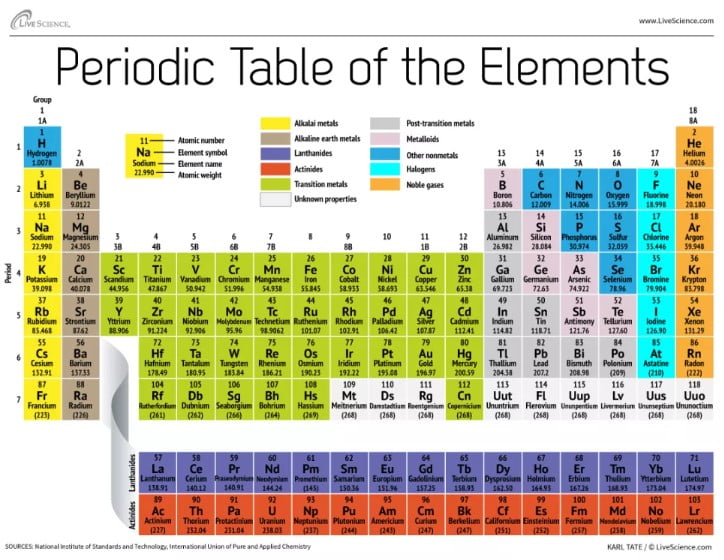
Periyodik tablo (periyodik cetvel) olarak da bilinir. Periyodik tablo tarihçesi, bilim insanlarının elementleri kütle, elektron sayısı, elektron dizilimi gibi özellikleri daha kolay ayırt edebilmesi için Dmitri Mendeleyev tarafından 1869 yılında hazırlanmıştır. Metaller cetvelin sağ tarafında yer alırken ametaller ise (yani metal olmayanlar) sol tarafta yer almaktadır.
Öğelerin periyodik tablosunu ve isimleri görüntülemek veya indirmek için tıklayın.
Periyodik Tablo Nedir Özellikleri Nelerdir?
( Kimyasal ) elementlerin periyodik tablosu olarak da bilinen periyodik tablo, kimyasal elementlerin tablo şeklinde gösterimidir.
Kimya , fizik ve diğer bilimlerde yaygın olarak kullanılır ve genellikle kimyanın simgesi olarak görülür. Kimyasal elementlerin özelliklerinin, atom numaralarına yaklaşık olarak periyodik bir bağımlılık sergilediğini belirten periyodik yasanın grafik bir formülasyonudur . Tablo, blok adı verilen dört kabaca dikdörtgen alana bölünmüştür.
Tablonun satırları denirnoktalar ve sütunlara gruplar denir . Periyodik tablonun aynı sütun grubundaki elementler benzer kimyasal özellikler gösterir. Eğilimler , bir periyot boyunca soldan sağa ve bir grup boyunca aşağıdan yukarıya doğru artan metalik olmayan karakter (kendi elektronlarını koruyarak) ve ters yönde artan metalik karakter (elektronları diğer atomlara teslim etme) ile periyodik tablo boyunca ilerler.
- Atom Yarıçapı.
- İyonlaşma Enerjisi (iyonlaşma potansiyeli)
- Elektron ilgisi.
- Elektronegatiflik.
- Metalik Karakter.
- Diğer Eğilimler.
- Redoks Potansiyelleri. Oksidasyon Potansiyeli. Azaltma Potansiyeli.
- Elementlerin Periyodik Özelliklerini bilmede kullanır
Bu eğilimlerin altında yatan neden , atomların elektron konfigürasyonlarıdır . Periyodik tablo, yalnızca eşit sayıda pozitif yüklü protona ve negatif yüklü elektrona sahip elektriksel olarak nötr atomları listeler ve izotopları koyar.(proton sayıları aynı fakat nötron sayıları farklı olan atomlar) aynı yerde. Nüklitler ve izotoplar gibi diğer atomlar, nüklid tabloları (genellikle Segrè çizelgeleri olarak adlandırılır) gibi diğer tablolarda grafiksel olarak toplanır.
Aşağıdaki periyodik tablo elementlerin isimleri, atom numaraları, sembolleri ve kütleleri öğrenciler ve araştırmacılar daha kolay anlayabilsin diye renklendirilmiştir.
Periyodik Tablo İndirmeleri

Periyodik tablo PDF ve yazdırabileceğiniz büyük resmi aşağıdaki linklerden indirebilirsiniz.
| İndirilebilir PDF | Yazdırılabilir Resim |
Periyodik Tablo, Atom Numarası ve Elektronegatiflik
Aşağıda verilen listede elementler alfabetik olarak dizilmiş olup sembolleri, atom numaraları ve elektronegativite değerleri verilmiştir.
Element İsimleri (Elementlerin Alfabetik sıralanışı)
| Element Adı | Sembol | Atom Numarası | Elektronegatiflik (χ) |
| Aktinyum | Ac | 89 | 1.1 |
| Alüminyum | Al | 13 | 1.61 |
| Amerikyum | Am | 95 | 1.3 |
| Antimon | Sb | 51 | 2.05 |
| Argon | Ar | 18 | |
| Arsenik | As | 33 | 2.18 |
| Astatine | At | 85 | 2.2 |
| Aynştaynyum | Es | 99 | 1.3 |
| Azot | N | 7 | 3.04 |
| Bakır | Cu | 29 element | 1.9 |
| Baryum | Ba | 56 | 0.89 |
| Berilyum | Be | 4 | 1.57 |
| Berkelyum | Bk | 97 | 1.3 |
| Bizmut | Bi | 83 | 2.02 |
| Bohriyum | Bh | 107 | |
| Bor | B | 5 | 2.04 |
| Brom | Br | 35 | 2.96 |
| Cıva | Hg | 80 | 2 |
| Darmstadyum | Ds | 110 | |
| Demir | Fe | 26 | 1.83 |
| Disprosyum | Dy | 66 | 1.22 |
| Dubniyum | Db | 105 | |
| Erbiyum | Er | 68 | 1.24 |
| Evropiyum | Eu | 63 | |
| Fermiyum | Fm | 100 | 1.3 |
| Flor | F | 9 | 3.98 |
| Fosfor | P | 15 | 2.19 |
| Fransiyum | Fr | 87 | 0.7 |
| Gadolinyum | Gd | 64 | 1.2 |
| Galyum | Ga | 31 | 1.81 |
| Germanyum | Ge | 32 | 2.01 |
| Gold | Au | 79 | 2.54 |
| Hafniyum | Hf | 72 | 1.3 |
| Hassiyum | Hs | 108 | |
| Helyum | He | 2 | |
| Hidrojen | H | 1 | 2.2 |
| Holmiyum | Ho | 67 | 1.23 |
| İndiyum | In | 49 | 1.78 |
| İridyum | Ir | 77 | 2.2 |
| İyot | I | 53 | 2.66 |
| Kadmiyum | Cd | 48 | 1.69 |
| Kaliforniyum | Cf | 98 | 1.3 |
| Kalsiyum | Ca | 20 | 1 |
| Karbon | C | 6 | 2.55 |
| Klor | Cl | 17 | 3.16 |
| Kobalt | Co | 27 | 1.88 |
| Kripton | Kr | 36 | 3 |
| Krom | Cr | 24 | 1.66 |
| Kurşun | Pb | 82 | 2.33 |
| Küriyum | Cm | 96 | 1.3 |
| Lantanyum | La | 57 | 1.1 |
| Lavrensiyum | Lr | 103 | |
| Lityum | Li | 3 | 0.98 |
| Lütesyum | Lu | 71 | 1.27 |
| Magnezyum | Mg | 12 | 1.31 |
| Manganez | Mn | 25 | 1.55 |
| Meitneryum | Mt | 109 | |
| Mendelevyum | Md | 101 | 1.3 |
| Molibdenyum | Mo | 42 | 2.16 |
| Neodimyum | Nd | 60 | 1.14 |
| Neon | Ne | 10 | |
| Neptünyum | Np | 93 | 1.36 |
| Nikel | Ni | 28 | 1.91 |
| Niyobyum | Nb | 41 | 1.6 |
| Nobelyum | No | 102 | 1.3 |
| Oganesson | Og | 118 | |
| Oksijen | O | 8 | 3.44 |
| Osmiyum | Os | 76 | 2.2 |
| Paladyum | Pd | 46 | 2.2 |
| Platinyum | Pt | 78 | 2.28 |
| Plütonyum | Pu | 94 | 1.28 |
| Polonyum | Po | 84 | 2 |
| Potasyum | K | 19 | 0.82 |
| Praseodim | Pr | 59 | 1.13 |
| Prometyum | Pm | 61 | |
| Protaktinyum | Pa | 91 | 1.5 |
| Radon | Rn | 86 | |
| Radyum | Ra | 88 | 0.9 |
| Renyum | Re | 75 | 1.9 |
| Rodyum | Rh | 45 | 2.28 |
| Röntgenyum | Rg | 111 | |
| Rubidyum | Rb | 37 | 0.82 |
| Rutenyum | Ru | 44 | 2.2 |
| Rutherfordyum | Rf | 104 | |
| Samaryum | Sm | 62 | 1.17 |
| Seryum | Ce | 58 | 1.12 |
| Sezyum | Cs | 55 | 0.79 |
| Klor | Cı | 17 | 3.16 |
| Krom | Cr | 24 | 1.66 |
| Kobalt | Ne | 27 | 1.88 |
| Bakır | İle | 29 | 1.9 |
| Küriyum | Cm | 96 | 1.3 |
| Darmstadtiyum | Ds | 110 | |
| Dubniyum | db | 105 | |
| Disporsiyum | iki | 66 | 1.22 |
| aynştaynyum | Es | 99 | 1.3 |
| erbiyum | Er | 68 | 1.24 |
| öropiyum | Ben mi | 63 | |
| Fermiyum | Fm | 100 | 1.3 |
| Flor | F | 9 | 3.98 |
| Fransiyum | Fr | 87 | 0.7 |
| Gadolinyum | Gd | 64 | 1.2 |
| galyum | ga | 31 | 1.81 |
| Germanyum | Ge | 32 | 2.01 |
| Altın | au | 79 | 2.54 |
| Hafniyum | Hf | 72 | 1.3 |
| hassiyum | Hs | 108 | |
| Helyum | He | 2 | |
| Holmiyum | Ho | 67 | 1.23 |
| Hidrojen | H | 1 | 2.2 |
| İndiyum | In | 49 | 1.78 |
| İyot | I | 53 | 2.66 |
| İridyum | Ir | 77 | 2.2 |
| Demir | Fe | 26 | 1.83 |
| Kripton | kr | 36 | 3 |
| lantan | La | 57 | 1.1 |
| Lawrencium | lr | 103 | |
| Kurşun | Pb | 82 | 2.33 |
| Lityum | Li | 3 | 0.98 |
| lutesyum | lu | 71 | 1.27 |
| Magnezyum | Mg | 12 | 1.31 |
| Manganez | Mn | 25 | 1.55 |
| Meitneriyum | Mt | 109 | |
| Mendelevium | Md | 101 | 1.3 |
| Cıva | Hg | 80 | 2 |
| Molibden | Mo | 42 | 2.16 |
| Neodimyum | nd | 60 | 1.14 |
| Neon | Ne | 10 | |
| Neptünyum | Np | 93 | 1.36 |
| Nikel | Ni | 28 | 1.91 |
| Niyobyum | Nb | 41 | 1.6 |
| Azot | N | 7 | 3.04 |
| Nobelyum | No | 102 | 1.3 |
| Oganesson | Og | 118 | |
| Osmiyum | Os | 76 | 2.2 |
| Oksijen | O | 8 | 3.44 |
| Palladyum | Pd | 46 | 2.2 |
| Fosfor | P | 15 | 2.19 |
| Platin | Pt | 78 | 2.28 |
| Plütonyum | Pu | 94 | 1.28 |
| Polonyum | Po | 84 | 2 |
| Potasyum | K | 19 | 0.82 |
| praseodim | Pr | 59 | 1.13 |
| Promethium | Pm | 61 | |
| Protaktinyum | Pa | 91 | 1.5 |
| Radyum | Ra | 88 | 0.9 |
| Radon | Rn | 86 | |
| Renyum | Re | 75 | 1.9 |
| Rodyum | Rh | 45 | 2.28 |
| Röntgenyum | rg | 111 | |
| Rubidyum | Rb | 37 | 0.82 |
| Rutenyum | Ru | 44 | 2.2 |
| Rutherfordiyum | Rf | 104 | |
| Samaryum | Sm | 62 | 1.17 |
| Skandiyum | sc | 21 | 1.36 |
| Seaborgiyum | Sg | 106 | |
| Selenyum | Se | 34 | 2.55 |
| Silisyum (Silikon) | Si | 14 | 1.9 |
| Gümüş | Ag | 47 | 1.93 |
| Sodyum | Na | 11 | 0.93 |
| Stronsiyum | Sr | 38 | 0.95 |
| Kükürt | S | 16 | 2.58 |
| Tantal | Ta | 73 | 1.5 |
| Teknesyum | Tc | 43 | 1.9 |
| Tellür | Te | 52 | 2.1 |
| Terbiyum | Tb | 65 | |
| Talyum | Tl | 81 | 1.62 |
| Toryum | Th | 90 | 1.3 |
| Tülyum | Tm | 69 | 1.25 |
| Kalay | Sn | 50 | 1.96 |
| Titanyum | Ti | 22 | 1.54 |
| Tungsten | W | 74 | 2.36 |
| ununbiyum | Uub | 112 | |
| ununtriyum | Uut | 113 | |
| ununpentiyum | Uup | 115 | |
| Fleroviyum | Fl | 114 | |
| Tennesin | Ts | 117 | |
| Livermoriyum | Lv | 116 | |
| Uranyum | U | 92 | 1.38 |
| Vanadyum | V | 23 | 1.63 |
| ksenon | Xe | 54 | 2.6 |
| İterbiyum | Yb | 70 | |
| İtriyum | Y | 39 | 1.22 |
| Çinko | Zn | 30 | 1.65 |
| Zirkonyum | Zr | 40 | 1.33 |
(Elektronegatiflik, kimyada bağ yapımında kullanılan elektronların bağı oluşturan atomlar tarafından çekilme gücüdür. Klor gibi dış enerji seviyeleri hemen hemen tamamen doldurulmuş atomlar güçlü elektronegatiftirler ve kolaylıkla elektron alırlar.)
Periyodik tablo kaç grup ve periyot var?
Modern periyodik tabloda 8 Adet A 10 Adet de B grubu vardır. Periyodik sistemde, soldan sağa doğru dizilmiş toplam 18 dikey sütun ve 7 periyot vardır. Gruplar aşağıda detaylı olarak verilmiştir:
| Grup numarası | Grup ismi | Mülk |
| Grup 1 veya 1A Grubu | Alkali metaller | Su ile güçlü alkaliler oluştururlar. Bu grupta Hidrojen hariç hepsi metaldir. |
| Grup 2 veya 2A Grubu | Toprak alkali metaller | Toprak alkali metalleri. Hepsi metaldir, ancak He=elementi 2 elektronla bitmesine rağmen 2A grubunda değil 8A grubuna aittir. (bu durum İstisnadır) |
| Grup 13 veya 3A Grubu | Bor ailesi | Toprak metalleri veya Bor grubu. Bor bu ailenin ilk üyesidir. |
| Grup 14 veya 4A Grubu | karbon ailesi | Karbon grubu. Carbon bu ailenin ilk üyesidir. |
| Grup 15 veya 5A Grubu | azot ailesi | Nitrojen veya Azot Grubu olarak adlandırılır. |
| Grup 16 veya 6A Grubu | oksijen ailesi | Oksijen veya Kalkojenler olarak da bilinirler. Oksijen doğada en çok bulunan elementtir. |
| Grup 17 veya 7A Grubu | halojen ailesi | Halojenler, bu grubun elementleri tuzları oluşturur. |
| Grup 18 veya 8A Grubu | sıfır grup | Soy gazlardır ve normal şartlar altında inert maddedirler |
Periyodik Tabloyu Okumak
Periyodik tablo muazzam miktarda bilgi içerir:
Atom numarası: Bir atomun çekirdeğindeki proton sayısı, o elementin atom numarası olarak adlandırılır. Proton sayısı, hangi element olduğunu tanımlar ve elementin kimyasal davranışını da belirler. Örneğin, karbon atomlarının her zaman altı protonu vardır; hidrojen atomlarında her zaman bir tane bulunur; ve oksijen atomları her zaman sekize sahiptir. Aynı elementin izotop adı verilen farklı versiyonları farklı sayıda nötrona sahip olabilir; ayrıca bir element, yüklü olmak için elektron kazanabilir veya kaybedebilir, bu durumda bunlara iyon denir.
Atom sembolü: Atom sembolü (veya element sembolü), bir elementi temsil etmek için seçilen bir kısaltmadır (karbon için (karbon için “C”, hidrojen için “H” ve oksijen için “O” vb.). Bu semboller uluslararası olarak kullanılır ve bazen semboller ve isimleri arasında farklılıklar olabilir. Örneğin, tungsten sembolü “W” dir çünkü bu elementin diğer adı wolframdır. Ayrıca, altının atom sembolü “Au”dur, çünkü Latince altın kelimesi “aurum”dur.
Atom kütlesi: Bir elementin standart atom ağırlığı, elementin atomik kütle birimleri (amu) cinsinden yazılan ortalama kütlesidir. Her atomun kabaca tam sayıda atomik kütle birimi olmasına rağmen, periyodik tablodaki atom kütlesinin bir ondalık sayı olduğunu fark edeceksiniz; bunun nedeni, sayının, bir elementin bolluklarına dayalı olarak doğal olarak oluşan çeşitli izotoplarının ağırlıklı ortalaması olmasıdır. Bir izotop, çekirdeğinde farklı sayıda nötron bulunan bir elementin bir versiyonudur. (Bir elementteki ortalama nötron sayısını hesaplamak için atom kütlesinden proton sayısını (atom numarası) çıkarın.)
Örneğin, iki izotopu olan karbonun atom kütlesini şu şekilde hesaplarsınız:
İzotopun bolluğunu atom kütlesiyle çarpın:
Karbon-12: 0.9889 x 12.0000 = 11.8668
Karbon-13: 0.0111 x 13.0034 = 0.1443
Ardından, sonuçları ekleyin:
11.8668 + 0.1443 = 12.0111 = karbonun atom ağırlığı
93-118 numaralı elementler için atom kütlesi: Los Alamos Ulusal Laboratuvarı (LANL), laboratuvarda oluşturulan uranyum ötesi elementler (atom numarası 92 olan uranyum dışındaki elementler) için “doğal” bir bolluk olmadığını kaydetti. Bu elementler için, en uzun ömürlü izotopun atom ağırlığı, kimyasal terminoloji ve terminoloji konusunda dünya otoritesi olan Uluslararası Temel ve Uygulamalı Kimya Birliği’ne (IUPAC) göre periyodik tabloda listelenir. LANL’ye göre gelecekte daha uzun bir yarı ömre sahip yeni bir izotop (bu elementin %50’sinin ayrışması ne kadar sürer) üretilebileceğinden, bu atom ağırlıkları geçici olarak kabul edilmelidir.
Süper ağır elementler veya atom numarası 104’ün üzerinde olanlar da bu doğal olmayan kategoriye girer. Atomun çekirdeği ne kadar büyükse – ki bu, içindeki proton sayısıyla artar – genellikle o element o kadar kararsızdır. Bu nedenle, bu büyük boyutlu öğeler, IUPAC’a göre daha hafif öğelere dönüşmeden önce yalnızca milisaniyeler süren kısa ömürlüdür.
Örneğin, süper ağır elementler 113, 115, 117 ve 118, IUPAC tarafından Aralık 2015’te doğrulandı ve tablodaki yedinci sırayı veya dönemi tamamladı. Birkaç farklı laboratuvar süper ağır elementleri üretti. Atom numaraları, geçici olan isimler ve resmi isimleri:
113: ununtriyum (Uut), nihonyum (Nh)
115: Ununpentium (Uup), Moskova (Mc)
117: ununseptium (Yeni), tennessine (Ts)
118: bir gece (Uuo), oganesson (Og)
Periyodik Tablo Bugün Nasıl Kullanılıyor?
Bilim insanları, bir araya getirilen belirli öğelerin belirli özelliklere ve davranışlara sahip olduğunu bilerek, belirli endüstriler ve süreçler için hangilerinin en iyi olacağını bulabilirler. Örneğin, Ulusal Standartlar ve Teknoloji Enstitüsü’ne göre mühendisler, galyum nitrür (GaN) ve İndiyum nitrür (InN) gibi yeni yarı iletken alaşımlar oluşturmak için tablonun Grup III ve V’deki farklı element kombinasyonlarını kullanır. (NIST).
Genel olarak kimyagerler ve diğer bilim insanları, belirli elementlerin birbirleriyle nasıl reaksiyona gireceğini tahmin etmek için tabloyu kullanabilirler.
Örneğin alkali metaller tablonun ilk sütununda veya grubundadır ve bir değerlik elektronuna sahip olma eğilimindedir ve bu nedenle +1 yük taşır. Kimyager Anne Marie Helmenstine, ThoughtCo’ya yazdığı bu yük, “su ile kuvvetli bir şekilde reaksiyona girdikleri ve ametallerle kolayca birleştikleri” anlamına geliyor.
NIST, kalsiyumla aynı grupta yer alan magnezyumun kemik implantları için alaşımların bir parçası olarak faydalı hale geldiğini söyledi. Bu alaşımlar biyolojik olarak parçalanabildikleri için bir yapı iskelesi görevi görürler ve yapılar üzerinde doğal kemik büyüdükten sonra kaybolurlar.